NPC1L1介导的内吞囊泡水平的胆固醇吸收的荧光可视化和评估
蛋白介导,它负责约70%的胆固醇吸收。NPC1L1缺陷小鼠对饮食诱导的高胆固醇血症具有抵抗力,这为通过抑制NPC1L1表达或活性来干预相关疾病提供了令人信服的策略。
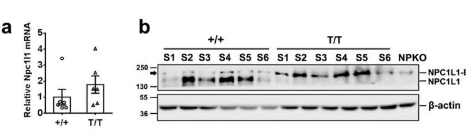
NPC1L1蛋白在小肠的刷状缘膜中表达。该蛋白质广泛N-糖基化,由1332个氨基酸和13个跨膜片段组成,这使得很难制备理想的抗体来分析其体内行为。基于体外细胞系的研究,推测NPC1L1通过网格蛋白介导的内吞作用介导胆固醇吸收。然而,这个概念也有一些未解决的挑战。实际上,NPC1L1与胆固醇的内吞囊泡尚未在生理条件下得到证实,因为没有可行的工具来可视化和评估NPC1L1囊泡在体内的内吞作用。
中国海军军医大学的科学家利用CRISPR/Cas9基因编辑技术构建了一种小鼠模型,其中内源性NPC1L1蛋白被标记有增强型绿色荧光蛋白(EGFP)。NPC1L1-EGFP小鼠使研究人员能够通过荧光观察和评估NPC1L1-cago在肠道胆固醇吸收过程中的囊泡内吞作用。这项研究在线发表在《生命新陈代谢》杂志上。
在这项研究中,发现纯合NPC1L1-EGFP敲入小鼠在“食物”或高胆固醇饮食条件下具有正常的胆固醇稳态。NPC1L1-EGFP融合蛋白的荧光定位于绒毛的刷状缘膜,而不是十二指肠、空肠和回肠中的隐窝,而不是结肠中的隐窝。该模式与对照小鼠中内源性NPC1L1分布的特征一致。早在5分钟内,EGFP阳性囊泡就在刷状缘膜下方可见,并在胆固醇口服灌胃后15分钟达到峰值。
值得注意的是,囊泡与早期内体标记物EEA1和菲律宾染色的游离胆固醇共定位,灌胃胆固醇引发EEA1阳性囊泡在刷状缘膜下的积累。用NPC1L1抑制剂依折麦布预处理可抑制这些胆固醇诱导的内吞囊泡的形成,进一步支持囊泡内吞作用参与NPC1L1介导的胆固醇吸收。
这项研究首次清楚地证明了在生理条件下肠道胆固醇吸收过程中NPC1L1内吞小泡中的游离胆固醇。它提供了一个可行的工具来评估NPC1L1货物的囊泡内吞作用以及在病理生理和药理学条件下体内的胆固醇吸收,并可用于药物发现。
此外,鉴于NPC1L1还介导非胆固醇甾醇(如植物甾醇和生育酚)的肠道吸收,该小鼠模型也有利于谷甾醇血症和维生素E缺乏症领域的研究人员。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
作为A股市场中极具代表性的黄金珠宝行业龙头企业,作为中国历史最悠久的珠宝品牌之一,老凤祥(股票代码:600612)...浏览全文>>
-
宝子们,杭州 房子装修完成啦!这次要给大家分享几家设计超赞的装修公司哦。它们各具特色,从空间规划到风格...浏览全文>>
-
欲筑室者,先治其基。在上海,装修房子对于每个业主而言,都是极为关键的一步,然而,如何挑选一家值得信赖的...浏览全文>>
-
2025年以来,联通支付严格贯彻落实国家战略部署,以数字和科技为驱动,做好金融五篇大文章,履行支付为民社会...浏览全文>>
-
良工巧匠,方能筑就华居;精雕细琢,方可打造美家。当我们谈论装修公司时,选择一家靠谱可靠的公司是至关重要...浏览全文>>
-
在当今社会,随着城市化进程的高速推进,建筑垃圾的产生量与日俱增。据权威数据显示,我国每年建筑垃圾产生量超 ...浏览全文>>
-
家人们,在上海要装修,选对公司那可太重要了!古语有云:"安得广厦千万间,大庇天下寒士俱欢颜。"一个温馨的...浏览全文>>
-
近年来,新能源汽车市场发展迅猛,各大品牌纷纷推出各具特色的车型以满足消费者多样化的需求。作为国内新能源...浏览全文>>
-
近年来,随着汽车市场的不断变化和消费者需求的升级,安徽滁州地区的宝来2025新款车型在市场上引起了广泛关注...浏览全文>>
-
随着汽车市场的不断变化,滁州地区的消费者对高尔夫车型的关注度持续上升。作为大众品牌旗下的经典车型,高尔...浏览全文>>
- 安徽滁州途安L新车报价2022款,最低售价16.68万起,入手正当时
- 小鹏G7试驾,新手必知的详细步骤
- 别克GL8预约试驾,4S店的贴心服务与流程
- 安徽阜阳ID.4 CROZZ落地价全解,买车必看的省钱秘籍
- 淮北探岳多少钱 2025款落地价,最低售价17.69万起现在该入手吗?
- 安徽淮南大众CC新款价格2025款多少钱能落地?
- 淮北长安启源C798价格,最低售价12.98万起现在该入手吗?
- 安徽淮南途锐价格,各配置车型售价全解析
- 蒙迪欧试驾预约,4S店体验全攻略
- 沃尔沃XC40试驾需要注意什么
- 滁州ID.4 X新车报价2025款,各车型售价大公开,性价比爆棚
- 试驾思域,快速操作,轻松体验驾驶乐趣
- 试驾长安CS35PLUS,一键搞定,开启豪华驾驶之旅
- 天津滨海ID.6 X落地价限时特惠,最低售价25.9888万起,错过不再有
- 天津滨海凌渡多少钱?看完这篇购车攻略再做决定
- 安徽池州长安猎手K50落地价,买车前的全方位指南
- 山东济南ID.6 CROZZ 2024新款价格,最低售价19.59万起,现车充足
- 试驾海狮05EV,新手必知的详细步骤
- 生活家PHEV多少钱 2025款落地价走势,近一个月最低售价63.98万起,性价比凸显
- 奇瑞风云A9试驾,新手必知的详细步骤
